StressMarq Biosciences 開發(fā)了一系列用于神經(jīng)退行性疾病研究的單體���、原纖維和寡聚體蛋白制劑����,包括 α 突觸核蛋白、β 突觸核蛋白����、γ 突觸核蛋白、tau�����、β 淀粉樣蛋白����、SOD1 和 TTR。我們的目標(biāo)是成為開發(fā)和供應(yīng)活性病理誘導(dǎo)蛋白聚集體的世界領(lǐng)先制造商��,以幫助科學(xué)家開發(fā)疾病模型并加速神經(jīng)退行性疾病藥物的研發(fā)��。
Alpha 突觸核蛋白單體, 寡聚體和前體原纖維 (PFFs)
Alpha Synuclein 是一種易溶的小分子蛋白質(zhì)���,沒有內(nèi)在結(jié)構(gòu)���,大量存在于大腦中���,主要存在于神經(jīng)元的突觸前末端。它參與突觸小泡釋放信號物質(zhì)的過程��,其中包括對運(yùn)動很重要的多巴胺���。 α-突觸核蛋白已被證明可以聚合成各種寡聚體和纖維形式�����,可溶的�、錯誤折疊的 α-突觸核蛋白聚集體具有神經(jīng)毒性��,并且可以以朊病毒樣方式傳播疾病�。 “突觸核蛋白病”是一類神經(jīng)退行性疾病��,包括帕金森病 (PD)��、路易體癡呆 (DLB)�����、彌漫性路易體病 (DLBD) 和多系統(tǒng)萎縮 (MSA)�,這些疾病都是由錯誤折疊的 α 突觸核蛋白引起的�����。事實(shí)上��,α-突觸核蛋白聚集是帕金森病的標(biāo)志�,不同形式的蛋白質(zhì)可用于開發(fā)重現(xiàn)這種疾病病理特征的疾病模型��。StressMarq提供用于神經(jīng)退行性疾病研究的 α 突觸核蛋白單體�����,寡聚體和原纖維等各種形態(tài)的構(gòu)建體�。這些制劑具有不同的特性和性質(zhì)。請觀看我們的視頻�,了解我們的 α 突觸核蛋白產(chǎn)品如何幫助科研學(xué)者開發(fā)疾病模型和測試候選藥物。
單體
StressMarq的 alpha 突觸核蛋白單體可以聚集但是沒有展現(xiàn)出神經(jīng)毒性����。
| 產(chǎn)品描述 | 目錄號 |
| 人 Alpha 突觸核蛋白單體 (1型) | SPR-321 |
| 人 Alpha 突觸核蛋白單體 (2型) | SPR-316 |
| 小鼠 Alpha 突觸核蛋白單體 (1型) | SPR-323 |
| 人 Alpha 突觸核蛋白 A53T 突變型單體 (1型) | SPR-325 |
| 人氨基末端乙酰化的Alpha 突觸核蛋白單體 (1型) | SPR-331 |
| 大鼠 Alpha 突觸核蛋白單體 | SPR-481 |
寡聚體?
α 突觸核蛋白寡聚體越來越多地被認(rèn)為是突觸核蛋白病中的最具毒性的物質(zhì)���。 StressMarq 的動態(tài)學(xué)穩(wěn)定的 α 突觸核蛋白寡聚體是在不添加任何誘導(dǎo)劑或抑制劑的情況下生產(chǎn)的�,對多巴胺能神經(jīng)元具有毒性,并可誘導(dǎo) α 突觸核蛋白 Ser129 的磷酸化(與帕金森病相關(guān)的病理學(xué)特征)�。 StressMarq 還提供多巴胺穩(wěn)定的 α 突觸核蛋白寡聚體和 EGCG 穩(wěn)定的 α 突觸核蛋白寡聚體。多巴胺和 EGCG 可用于穩(wěn)定寡聚體形式的 α-突觸核蛋白�����,防止其進(jìn)一步聚集成原纖維���。
| 產(chǎn)品描述 | 目錄號 | 單體來源 |
| 人 Alpha 突觸核蛋白寡聚體 (動態(tài)學(xué)穩(wěn)定的) | SPR-484 | 人 Alpha 突觸核蛋白單體 (2型), 目錄號 SPR-316 |
| 人 Alpha 突觸核蛋白寡聚體 (鹽酸多巴胺穩(wěn)定的) | SPR-466 | 人 Alpha 突觸核蛋白單體 (2型), 目錄號 SPR-316 |
| 人 Alpha 突觸核蛋白寡聚體 (EGCG 穩(wěn)定的) | SPR-469 | 人 Alpha 突觸核蛋白單體 (2型), 目錄號 SPR-316 |
前體原纖維 (PFFs)?
StressMarq 的 alpha 突觸核蛋白前體原纖維 (PFFs) 可以聚集alpha 突觸核蛋白活性單體形成新的原纖維, 并且可以用于誘導(dǎo)內(nèi)源性alpha突觸核蛋白的磷酸化和神經(jīng)元中路易體的形成����,以及體外寡聚化研究����。
| 產(chǎn)品描述 | 目錄號 | 單體來源 |
| 人 Alpha 突觸核蛋白前體原纖維 (1型) | SPR-322 | ?人 Alpha 突觸核蛋白單體, 目錄號 SPR-321 |
| 人 Alpha 突觸核蛋白前體原纖維 (ATTO 594 標(biāo)記的, 1型) | SPR-322-A594 | 人 Alpha 突觸核蛋白單體, 目錄號 SPR-321 |
| 小鼠 Alpha 突觸核蛋白前體原纖維 (1型) | SPR-324 | 小鼠 Alpha 突觸核蛋白單體, 目錄號 SPR-323 |
| 人 Alpha 突觸核蛋白前體原纖維 (2型) | SPR-317 | 人 Alpha 突觸核蛋白單體 (2型), 目錄號 SPR-316 |
| 人氨基末端乙酰化的 Alpha 突觸核蛋白前體原纖維 (1型) | SPR-332 | 人氨基末端乙?����;?Alpha 突觸核蛋白單體, 目錄號 SPR-331 |
| 人 Alpha 突觸核蛋白 A53T 突變型前體原纖維 (1型) | SPR-326 | 人 A53T Alpha 突觸核蛋白單體 (1型), 目錄號 SPR-325 |
| 大鼠 Alpha 突觸核蛋白前體原纖維 | SPR-482 | 大鼠 Alpha 突觸核蛋白單體, 目錄號 SPR-481 |
| 人 Alpha 突觸核蛋白前體原纖維 (3型) | SPR-448 | 人 Alpha 突觸核蛋白單體 (2型), 目錄號 SPR-316 |
| 人 Alpha 突觸核蛋白纖絲 (未成熟的原纖維) | SPR-450 | 人 Alpha 突觸核蛋白單體, 目錄號 SPR-321 |
Alpha 突觸核蛋白前體原纖維 (PFFs) 在細(xì)胞之間的傳遞
StressMarq 的 Alpha 突觸核蛋白 PFFs 目錄號 SPR-322 (下圖 紅色 顯示的), 在14天內(nèi)由 SH-SY5Y 細(xì)胞轉(zhuǎn)移到了神經(jīng)元 iPSCs 中����。
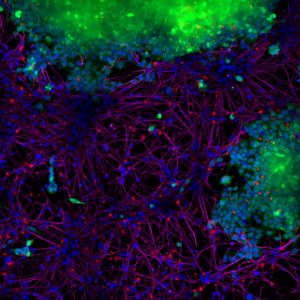 |
| 藍(lán)色: Hoechst/DNA | 綠色: SHSY5Y-GFP | 紅色: StressMarq的 α-syn PFFs-555 | 紫色: Tubulin |
Alpha 突觸核蛋白單體�����,寡聚體和前體原纖維(PFFs)的二級結(jié)構(gòu)
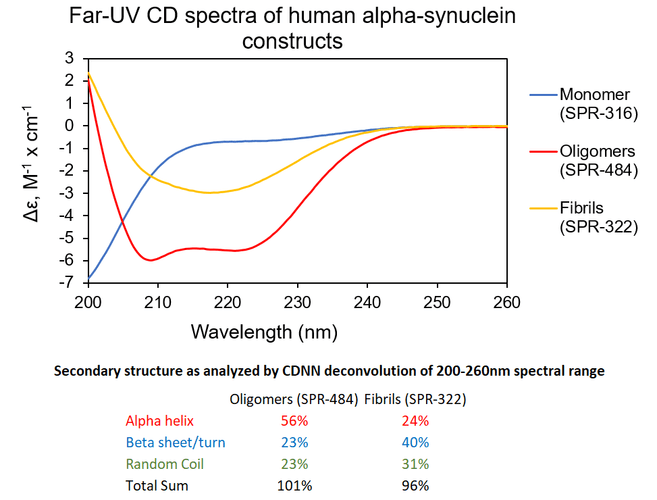
寡聚體 & 原纖維. UV-CD 數(shù)據(jù)顯示 StressMarq的 Alpha 突觸核蛋白寡聚體有特別的不同于單體和原纖維的二級結(jié)構(gòu)。具體一點(diǎn)說, 我們的動態(tài)學(xué)穩(wěn)定的 Alpha 突觸核蛋白寡聚體 (目錄號 SPR-484) 顯示出比Alpha 突觸核蛋白前體原纖維(Type 1) (目錄號 SPR-322) 明顯更高的 alpha 螺旋含量和更低的beta折疊含量����。Alpha 突觸核蛋白單體 (目錄號 SPR-316) 在 200 nm處顯示出很強(qiáng)的負(fù)信號,表明蛋白處于無序結(jié)構(gòu)狀態(tài) (缺乏二級結(jié)構(gòu)).
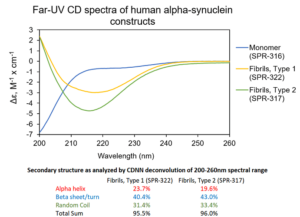
1 型 & 2 型前體原纖維. UV-CD 數(shù)據(jù)顯示 StressMarq 的 Alpha 突觸核蛋白前體原纖維 (PFFs), 1 型 (目錄號SPR-322) 和 2 型 (目錄號 SPR-317) 都含有 較高的 beta 折疊�����,但是二級結(jié)構(gòu)確實(shí)有輕微差別����。Alpha 突觸核蛋白單體 (目錄號 SPR-316) 在 200 nm處顯示出很強(qiáng)的負(fù)信號,表明蛋白處于無序結(jié)構(gòu)狀態(tài) (缺乏二級結(jié)構(gòu)). 在這個實(shí)驗(yàn)中, 前體原纖維 (PFFs) 進(jìn)行了 10 個循環(huán)的超聲處理以確保測量之前的可溶性���。
動態(tài)學(xué)穩(wěn)定的 Alpha 突觸核蛋白寡聚體誘發(fā)毒性和病理學(xué)現(xiàn)象
動態(tài)學(xué)穩(wěn)定的 alpha 突觸核蛋白寡聚體 (目錄號 SPR-484) 對多巴胺能神經(jīng)元有毒性并且能誘發(fā)alpha 突觸核蛋白 Ser129 號位的磷酸化, 這是帕金森疾病的標(biāo)志性病理現(xiàn)象�。該寡聚體在一次凍融以后或者37攝氏度孵育兩周后依然穩(wěn)定�����。
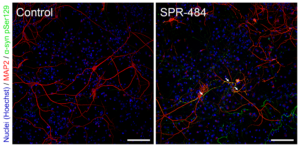 | 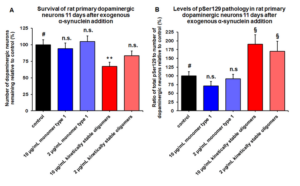 | 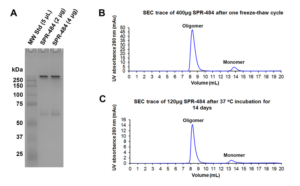 |
| 動態(tài)學(xué)穩(wěn)定的alpha突觸核蛋白寡聚體 (目錄號 SPR-484)��。在原代大鼠多巴胺能細(xì)胞中誘發(fā)帕金森相關(guān)的 pSer129 病理現(xiàn)象��。? | 動態(tài)學(xué)穩(wěn)定的 alpha 突觸核蛋白寡聚體 (目錄號 SPR-484) 顯示出對原代大鼠多巴胺能神經(jīng)元的毒性。 | 動態(tài)學(xué)穩(wěn)定的 alpha 突觸核蛋白寡聚體 (目錄號 SPR-484) 在一次凍融以后或者37攝氏度孵育兩周后依然穩(wěn)定. |
?
StressMarq Alpha 突觸核蛋白產(chǎn)品的引用發(fā)表文獻(xiàn)
人 Alpha 突觸核蛋白 (1 型), 目錄號 SPR-322
1.Deciphering the role of hsp110 chaperones in diseases of protein misfolding. Yakubu, U. M. (2021) PhD Thesis, University of Texas.
2.Suppression of aggregate and amyloid formation by a novel intrinsically disordered region in metazoan Hsp110 chaperones. Yakubu, U.M., Morano, K.A. (2021) J Biol Chem Jan-Jun 2021;296:100567.? ?Read a summary of this paper on our blog.
3.Design, Synthesis and Chemically Engineered Graphene Quantum Dot Applications: Contrast Agent for MR Imaging and Targeted Therapeutics on Parkinson’s Treatment. Poonkuzhali, K. et al. (2022) SSRN 4056733.
小鼠 Alpha 突觸核蛋白前體原纖維 (1型), 目錄號 SPR-324
1.The SUMO conjugase Ubc9 protects Dopaminergic cells from cytotoxicity and enhances the stability of α-synuclein in Parkinson’s disease models. Verma, D.K. et al. (2020) eNeuro 0134-20.2020.? Read a summary of this paper on our blog.
2.Alpha-Synuclein Preformed Fibrils Induce Cellular Senescence in Parkinson’s Disease Models. Verma, D.K. et al. (2021) Cells 10, 1694.
3.Heat Shock Protein 70 as a Sex-Skewed Regulator of α-Synucleinopathy. (2021) Bhatia, T. N. et al. Neurotherapeutics Oct;18(4):2541-2564.
4.Domain-Independent Inhibition of CBP/p300 Attenuates α-Synuclein Aggregation. Hlushchuk, I. et al. (2021) ACS Chem. Neurosci. Jul 7;12(13):2273-2279.
人 Alpha 突觸核蛋白 A53T 突變型前體原纖維 (1型), 目錄號 SPR-326
1.Environmental enrichment reduced pathological α-Synuclein accumulation by restoring LAMP1 via Reelin in early stage of Parkinson’s disease. Cho, E. (2021) PhD Thesis, Yonsei University.
2.Reelin Alleviates Mesenchymal Stem Cell Senescence and Reduces Pathological α-Synuclein Expression in an In Vitro Model of Parkinson’s Disease. Cho, E. (2021) Genes 12, 1066.
人 Alpha 突觸核蛋白前體原纖維 (2 型), 目錄號 SPR-317
1.Directed Evolution of Antibodies Against Complex Targets. Desai, A. (2021) PhD Thesis, University of Michigan.
如需訂購Stressmarq品牌產(chǎn)品�,請聯(lián)系一級代理商-欣博盛生物
全國服務(wù)熱線: 4006-800-892? ? ? ?郵箱: market@neobioscience.com? ?
深圳: 0755-26755892? ? ? ?北京: 010-88594029? ? ? ? ?
上海: 021-34613729? ? ? ? ?廣州: 020-87615159? ? ? ? ??
代理品牌網(wǎng)站: www.yuebanme.com? ?
自主品牌網(wǎng)站: www.neobioscience.net