Funakoshi LipiDye II是一款適用于長時間活細胞成像以觀察動態(tài)脂滴(LDS)合成��、移動或降解的綠色熒光染料�;是LipiDye(貨號:FDV-0010)的升級版����,同時具備超強的光穩(wěn)定性和高靈敏度等特點��。
?
??產品信息
| 貨號 | FVD-0027 |
規(guī)格 | 0.1mg |
化學式 | C26H17NO2S2 |
分子大小 | 439.5 g/mol |
溶解性 | 溶于DMSO |
熒光特性 | Ex. 400-500 nm(maximum ~420 nm) 與藍色激發(fā)激光器(如405����、445�、458、473和488 nm*激光器等)����、氙燈或帶有商用FITC或GFP濾光片的LED兼容; 注:488 nm可激發(fā)LipiDye II��,但與473 nm激發(fā)相比熒光較弱�����。 如果使用488 nm激光��,請根據(jù)實驗經驗優(yōu)化成像條件�,如染料濃度等。 Em. 450-650 nm(取決于溶劑) 如豆油的最大值~510nm��,與LD相似����。建議在490-550 nm范圍內使用�。 |
??產品特點
? 可檢測非脂肪細胞中直徑?
???適用于長時間活細胞成像,具有超強的光穩(wěn)定性����。
???適用脂滴分解與合成。
???適用于脂肪細胞分化過程���,時間可長達8天����。
???適用于活細胞�����、固定處理的細胞以及活細胞染色后再固定細胞染色���。
???推薦使用濃度為0.1~1 μM,對細胞幾乎無毒性��。
???可對細胞脂滴進行半定量分析���。
?
●?脂滴與LipiDye II
脂滴(Lipid droplets�����,LDs)是一種具有獨特的單層磷脂�,可儲存甘油三酯和甾醇酯等中性脂質的細胞器(圖1)。LDs普遍存在于脂肪細胞中���,具有儲存能量和脂質運輸?shù)墓δ?��。研究發(fā)現(xiàn),LDs不僅存在于脂肪細胞���,還存在肝細胞和神經膠質細胞等其他非脂肪細胞中��,明確LDs具有調節(jié)代謝以及保護鄰近細胞免受脂質毒性的功能���。LDs的數(shù)量大小以及組成因細胞類型的不同而不同。例如���,脂肪細胞中LDs的直徑?>?10μm��,可通過光學顯微鏡觀察到����;而非脂肪細胞中LDs的直徑在0.1μm~1μm(圖2)。因此��,實現(xiàn)可以檢測出活細胞中非脂肪細胞的微小LDs的動態(tài)運動及功能將是一個重要突破��。
?
傳統(tǒng)的LDs熒光染料(如尼羅河紅)僅限于檢測脂肪細胞或經過量脂質處理的細胞中相對較大的LDs��;在活細胞條件下無法實現(xiàn)檢測存在于非脂肪細胞的微小LDs��。Funakoshi的LipiDye(貨號:FDV-0010)可檢測1μm大小的LDs����,雖然其具備高靈敏度和高選擇性,但LipiDye需要405?nm的激發(fā)波長���,光穩(wěn)定性不足�����,不適合用于長期活細胞成像以觀察動態(tài)LDs的合成�、移動或降解�。
?
因此���,F(xiàn)unakoshi又推出了LipiDye的升級版—LipiDye II�����,可被毒性較低的450-480 nm激發(fā)����,并具有超強的光穩(wěn)定性;同時適用于長時間活細胞成像��,包括短期多時間激發(fā)的Z-stack延時成像���。
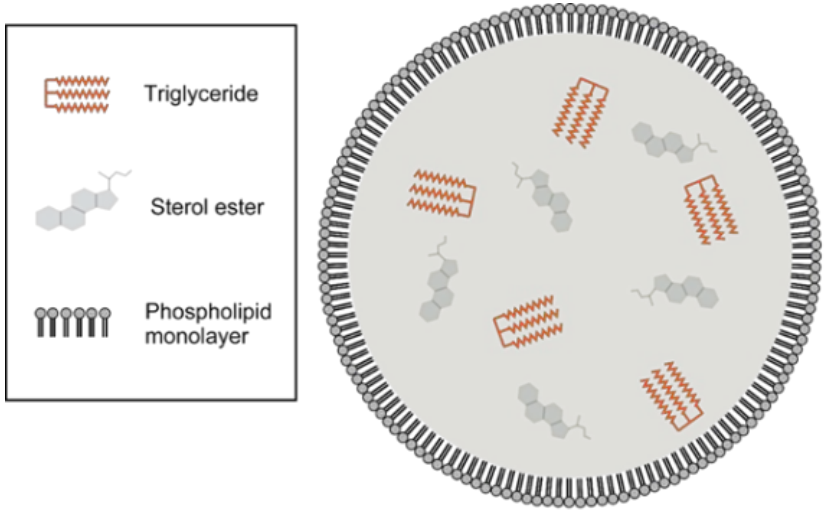
圖1 脂滴的結構與組成
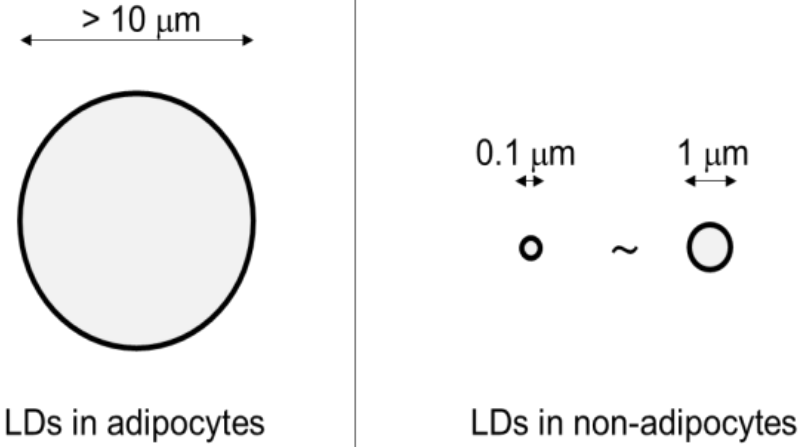
圖2?脂滴在脂肪細胞和非脂肪細胞的直徑大小
?
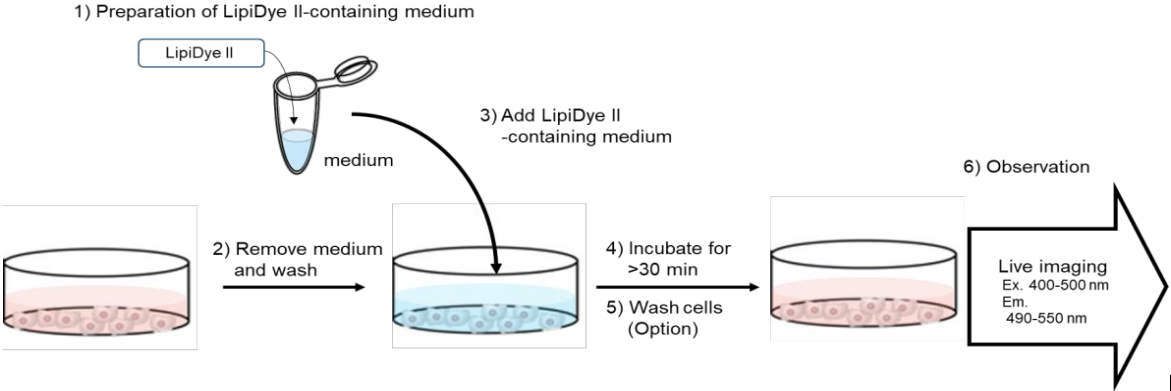
●?活細胞成像的一般步驟
1����、在無血清�、無酚紅的培養(yǎng)基中配制1 μM的LipiDye II;
(注:LipiDye II可與含F(xiàn)BS的培養(yǎng)基兼容��,但需優(yōu)化FBS和LipiDye II的濃度�����;推薦濃度0.1 μM用~405 nm激發(fā)����,濃度1μM用~473 nm激發(fā)�;根據(jù)實驗經驗優(yōu)化并確定LipiDye II的濃度)
2�、去除培養(yǎng)基,用PBS沖洗細胞數(shù)次���;
3���、向細胞中加入含LipiDye II的培養(yǎng)基;
4����、37℃孵育30分鐘以上(注:根據(jù)實驗經驗優(yōu)化孵育時間);
5���、使用PBS或培養(yǎng)基清洗細胞并加入新鮮培養(yǎng)基(可選)�;
6��、觀察細胞���。
??參考數(shù)據(jù)
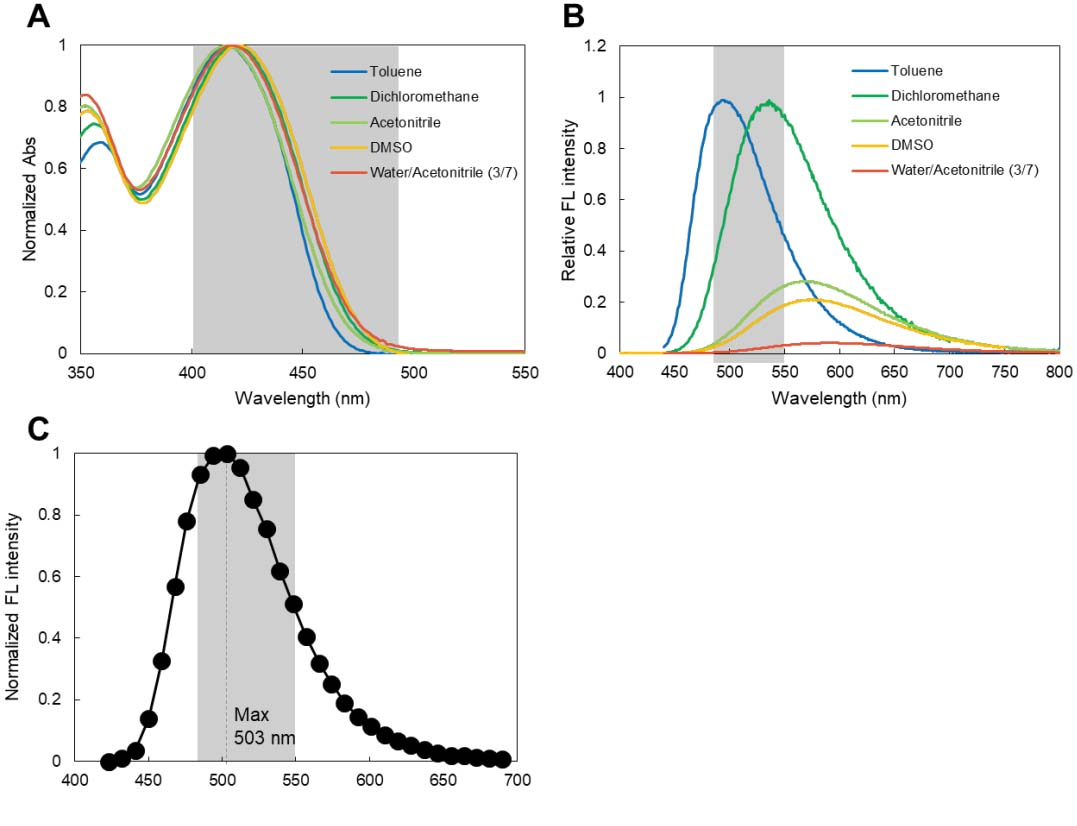
●?LipiDye II的光譜
 ?
?
圖A:LipiDye II的吸收光譜幾乎不受溶劑影響��,可觀察LipiDye II在400?nm~500?nm的吸收�。
圖B:LipiDye II在不同溶劑中有不同的發(fā)射光譜。如在甲苯和二氯甲烷等低極性溶劑中�����,它發(fā)出的熒光從藍色到綠色�����,量子產率高���;另一方面,在高極性溶劑(乙腈�����、二甲基亞砜和水)中��,LipiDye II則表現(xiàn)出弱熒光強度和紅移熒光�。
圖C:用LipiDye II對細胞染色,在熒光顯微鏡下約500?nm處觀察細胞中LDs的發(fā)射光譜���。
??
●?LipiDye II的光穩(wěn)定性
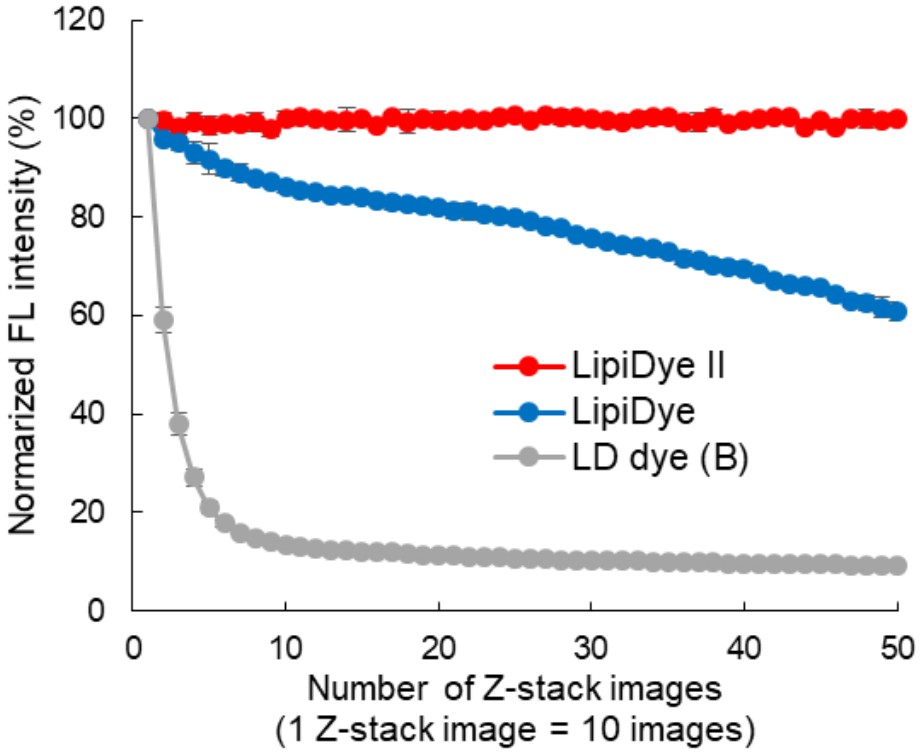
分別使用 LipiDye II(紅)��、舊版LipiDye(藍)和傳統(tǒng)LD?dye B(灰)對提前固定在4%?甲醛中的3T3-L1脂肪細胞進行染色�����;然后用共聚焦顯微鏡(Ex.?473 nm/Em 490-540 nm)反復采集同一區(qū)域脂肪細胞的Z-stack成像�,觀察熒光強度的變化。傳統(tǒng)染料B的熒光強度在5次Z-stack成像后�,熒光強度顯著降低;舊版LipiDye在經過50次Z-stack成像后�,其熒光強度則逐漸降低約60%。而LipiDye II 即使經過50次(共500次光照射)�����,其熒光強度幾乎沒有任何變化�����。證明LipiDye II非常適用于長時間的延時成像���,具有超強的光穩(wěn)定性����。
 ?
?
?
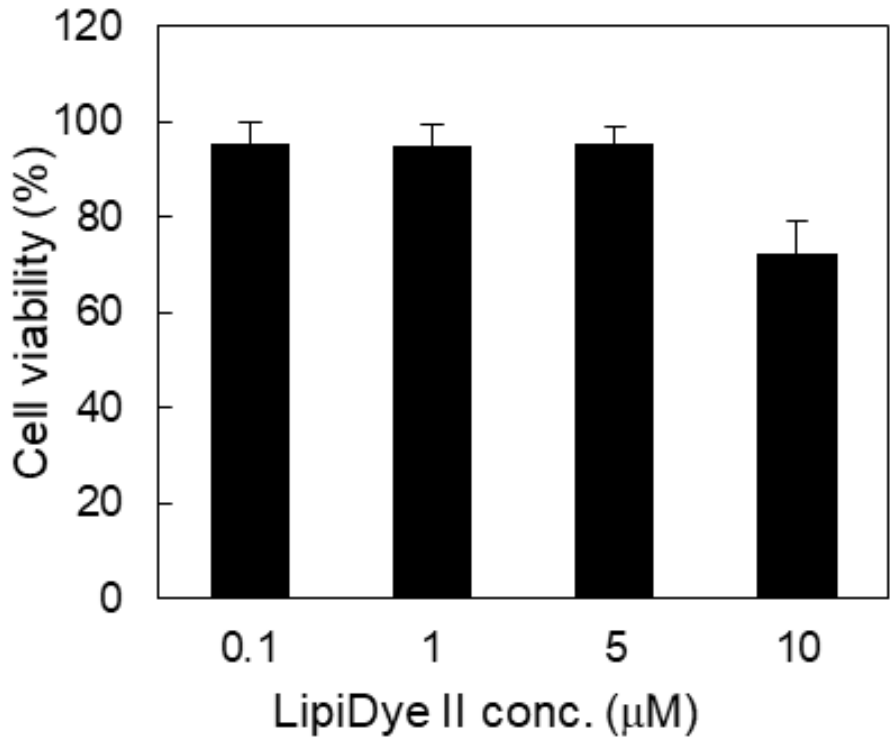
●?LipiDye II的細胞毒性
使用不同濃度的LipiDye II培養(yǎng)3T3-L1脂肪細胞24小時�。隨后用MTT法評估細胞活力。結果顯示LipiDye II
 ?
?
●?活細胞和PFA固定細胞染色
使用LipiDye II染色在活細胞狀態(tài)下的3T3-L1脂肪細胞,進行活細胞成像���。然后用4%?PFA固定3T3-L1脂肪細胞�,再次進行熒光觀察(Ex. nm/Em 490-540 nm)��。細胞在固定前后的熒光強度幾乎沒有任何變化�,證明LipiDye II可用于活細胞染色,也可用于活細胞成像后的任何免疫細胞化學實驗�����。
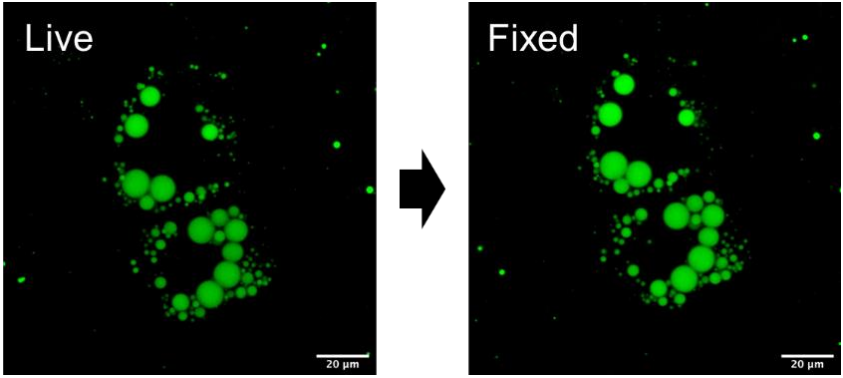
LipiDye?染色的活細胞和經PFA固定后的熒光強度的對比
?
??應用數(shù)據(jù)
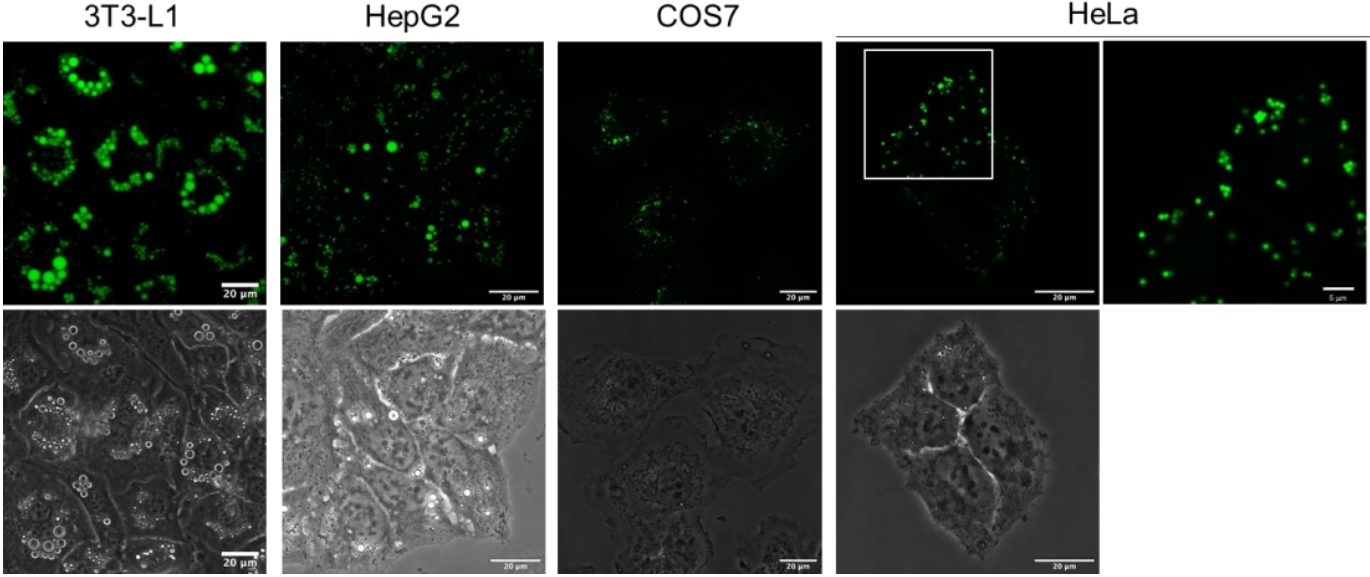
●?LipiDye II在不同細胞中的染色
使用LipiDye II(1μM)分別對3T3-L1���、HepG2�����、COS-7和HeLa細胞染色12小時�����,隨后在熒光顯微鏡下觀察(Ex. 473 nm/Em 490-540 nm���;比例尺:20μm)����。在HepG2細胞染色前一天�,使用棕櫚酸(0.33 mM)/油酸(0.66 mM)處理誘導脂滴形成;HeLa細胞中�,可清晰觀察到約1 μm的微小LDs(比例尺:5μm)。
?
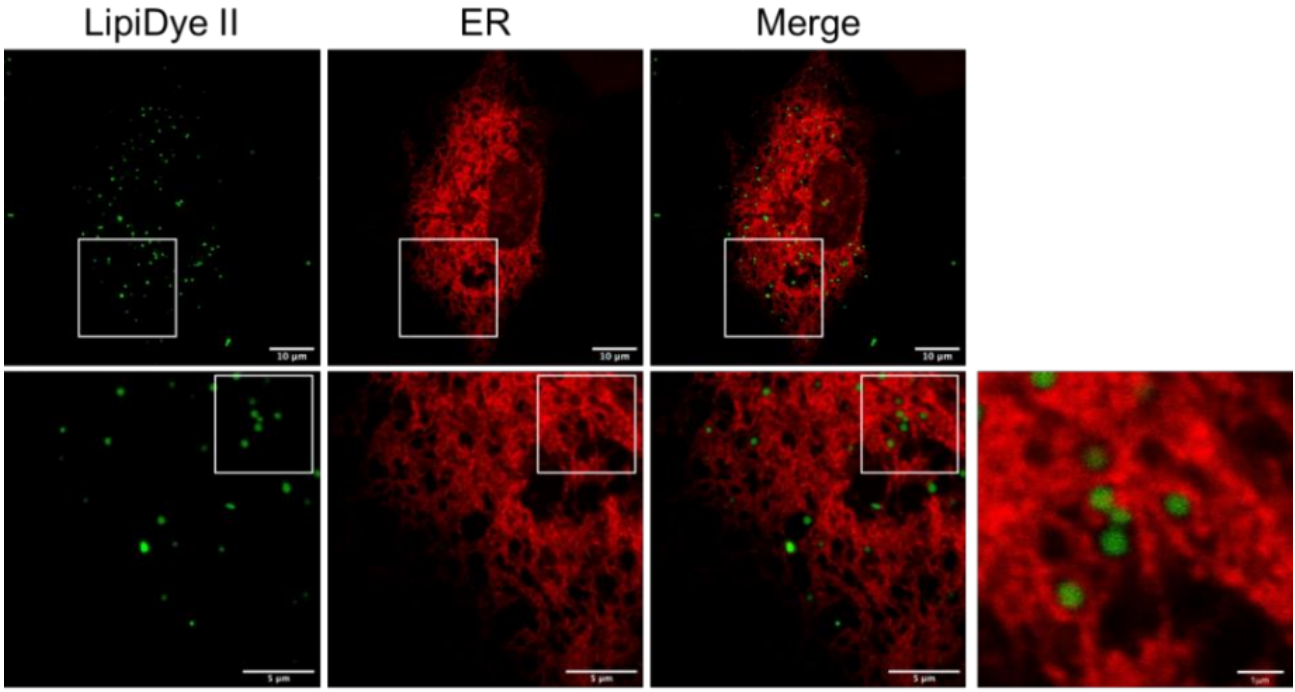
●?內質網(wǎng)(ER)標記的多色成像
用LipiDye II(1 μM)對表達ER駐留熒光蛋白(mKO1)的COS7細胞染色12小時�。然后使用共聚焦顯微鏡觀察COS7細胞(LipiDye II:Ex. 473 nm/Em 490-540 nm;mKO1:?Ex. 635 nm/Em 660-710 nm)����。在ER的網(wǎng)絡結構中可以觀察到?< 1 μm的微小LDs。(比例尺:20 μm�����、5 μm和1 μm)
?
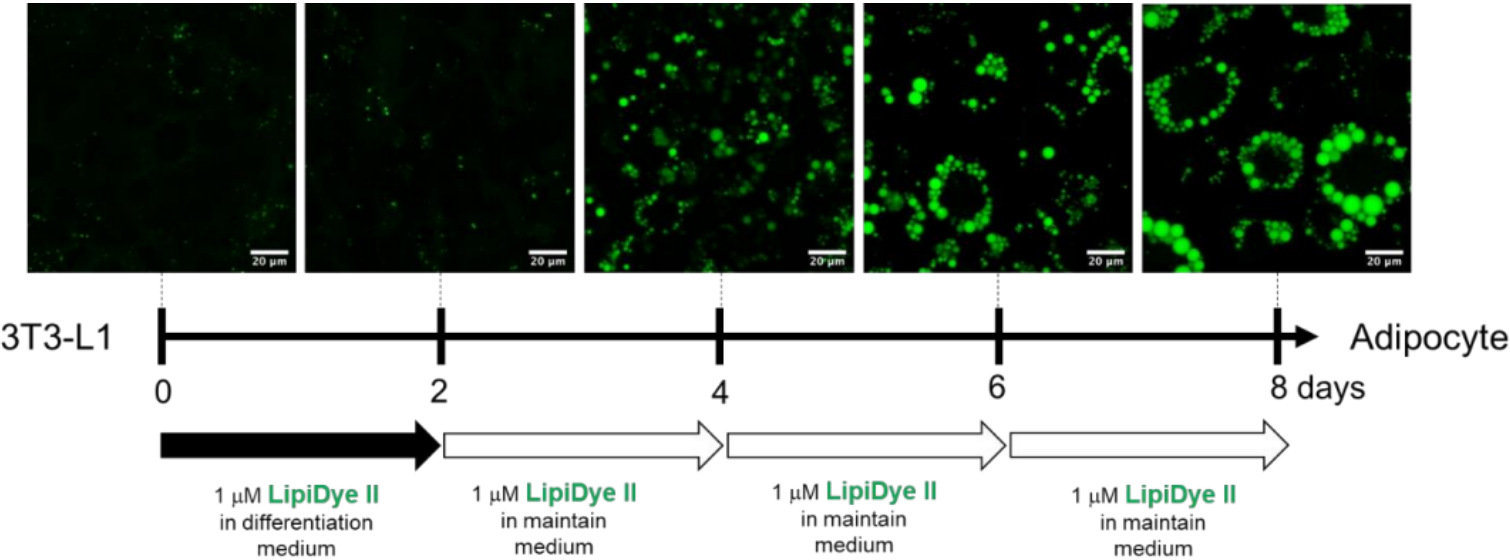
●?LipiDye II在脂肪細胞分化和成熟過程中的長時間染色
使用含LipiDye II(1μM)的培養(yǎng)基誘導3T3-L1前脂肪細胞分化為3T3-L1成熟脂肪細胞��。含LipiDye II的分化培養(yǎng)基培養(yǎng)前脂肪細胞2天后,每隔2天用含LipiDye II的維持培養(yǎng)基�����,在共聚焦激光顯微鏡下觀察8天�����。結果證明��,LipiDye II可以對活細胞進行長時間處理�,觀察脂滴的成熟過程�����。整個分化過程中沒有出現(xiàn)對細胞的毒性作用���,同時也沒有影響細胞的分化���。
?
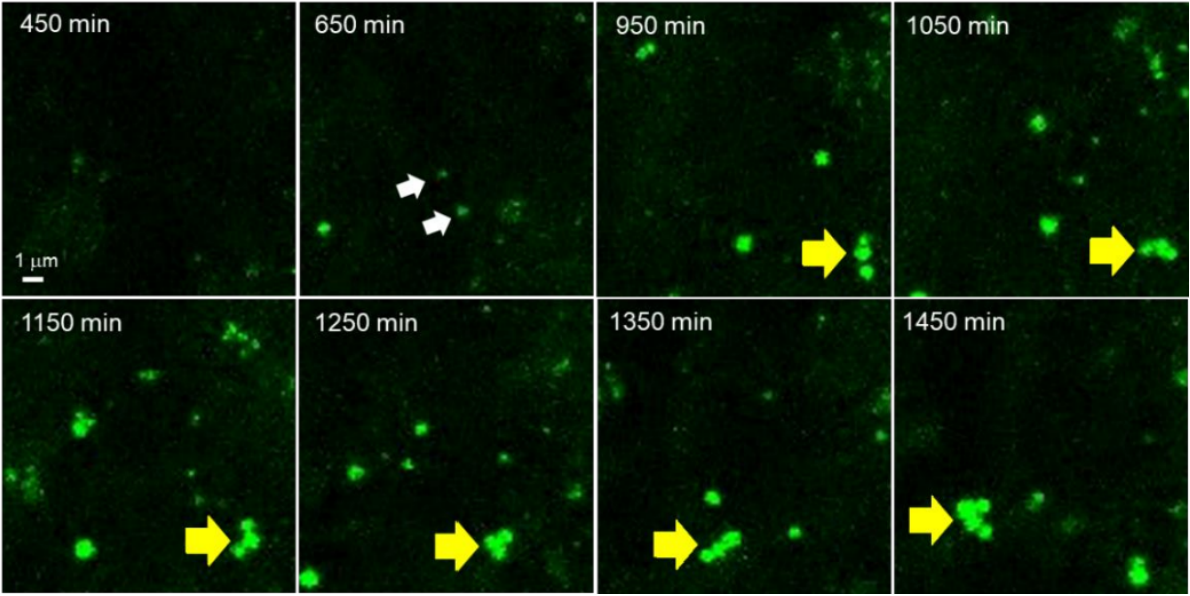
●?脂肪生成的Z-stack成像
使用含LipiDye II(1μM)的分化培養(yǎng)基培養(yǎng)3T3-L1前脂肪細胞24小時,并進行Z-stack成像����。分化約10小時后���,通過共聚焦顯微鏡(Ex. 473 nm/Em 490-540 nm)觀察到有微小的LDs生成(650分鐘,白色箭頭)���;同時可觀察到各脂滴在相互作用���,逐漸變大的動態(tài)(1050~1450分鐘,黃色箭頭)��。
 ?
?
?
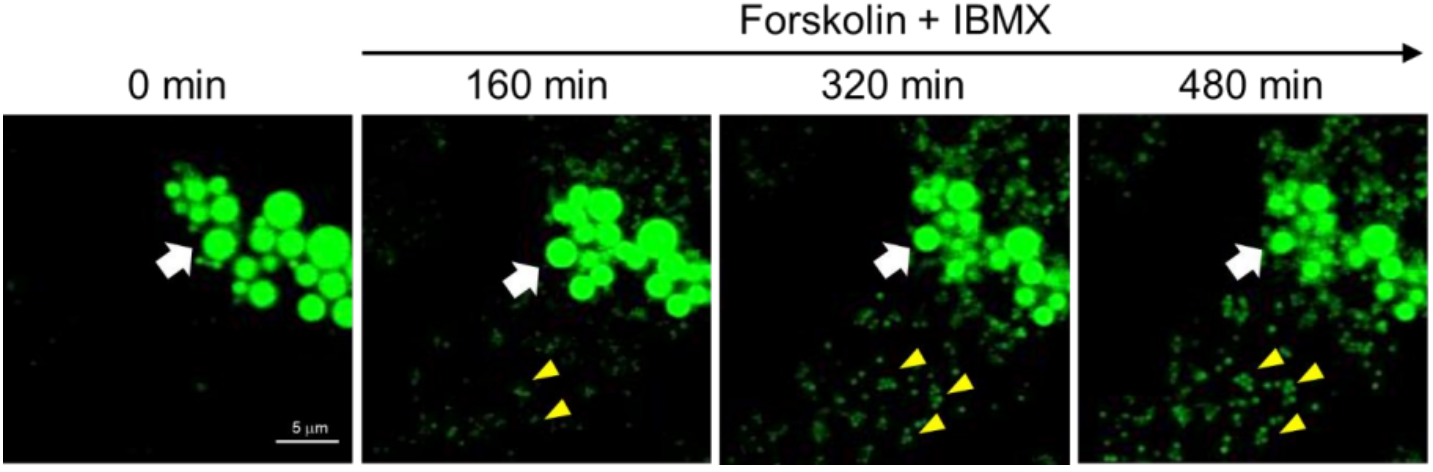
●?脂肪分解的Z-stack成像
將3T3-L1脂肪細胞和LipiDye II(1μM)共同孵育���,然后用腺苷酸環(huán)化酶激活劑(Forskolin����,10 μM)和磷酸二酯酶抑制劑IBMX(100 nM)處理細胞來增加脂肪細胞內cAMP的濃度��,從而促進三酰甘油的水解���。
添加Forskolin和IBMX后�,立即使用共聚焦顯微鏡(Ex. 473 nm/Em 490-540 nm)進行Z-stack成像(持續(xù)800分鐘�,共3000幅圖像)。兩小時后,觀察到許多微小LDs形成(比例尺:5 μm)�。
 ?
?
?
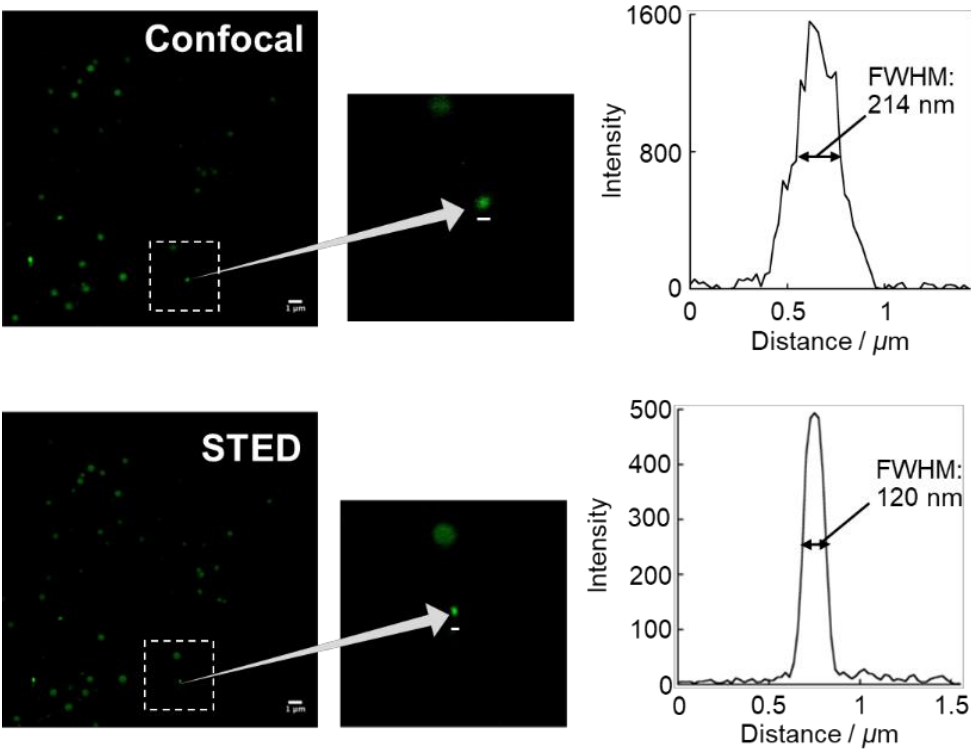
●?STED 超分辨率顯微成像微小脂滴
用LipiDye II(1μM)對HeLa細胞進行染色。通過激光共聚焦顯微鏡(Ex. 473 nm/Em 490-540 nm)和STED超高分辨率顯微鏡(Ex.473 nm/ Em?500-640 nm���、STED 660 nm)觀察微小脂滴���。STED 成像可檢測到半峰全寬(FWHM)約120?nm的微小脂滴,而共聚焦顯微鏡無法清晰檢測���。(關于STED顯微鏡的觀察條件及分析方法����,請見參考文獻)
 ?
?
?
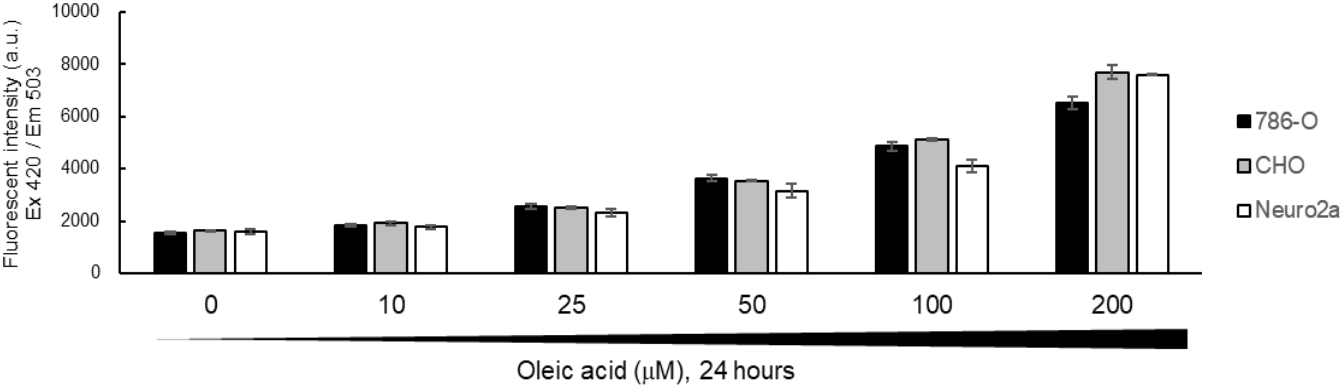
●?利用熒光酶標儀對細胞脂滴進行半定量分析
首先將三種細胞株(人腎癌細胞786-O��、小鼠腦神經瘤細胞Neuro-2a和中國倉鼠卵巢細胞CHO)分別以1 x 104個細胞/孔的數(shù)量接種到96孔板中�����,并在含有10% FBS的DMEM中培養(yǎng)24小時���,再用10~200 μM 油酸處理細胞24小時,以促進脂滴的生長�。然后用含有2% FBS/DMEM 的5 μM LipiDye II染色2小時。PBS沖洗細胞兩次,用熒光酶標儀測量熒光強度(Ex 420 ±5 nm/Em 503 ±10 nm)��。結果顯示在這三種細胞中觀察到脂滴對油酸具有劑量依賴性����。
?
??參考文獻
1. Taki et al.,ACS. Mater. Lett.., 3, 42-49 (2021), Fused Thiophene-S,S,-dioxide-Based Super-Photostable Fluorescent Marker for Lipid Droplets
?
?

更多詳情請聯(lián)系Funakoshi中國授權代理商——欣博盛生物?
全國服務熱線: 4006-800-892? ? ? ?郵箱: market@neobioscience.com? ??
深圳: 0755-26755892? ? ? ?北京: 010-88594029? ? ? ? ??
上海: 021-34613729? ? ? ? ?廣州: 020-87615159? ? ? ? ? ?
代理品牌網(wǎng)站: www.yuebanme.com? ??
自主品牌網(wǎng)站: www.neobioscience.net