
安捷倫(Prozyme)?2-AB染料高通量糖型分析平臺
摘要
本應用簡報介紹由生物治療性糖蛋白進行N-糖鏈前處理�,用于釋放糖鏈分析。N-糖鏈分析對治療性蛋白質的開發(fā)和生產十分重要��,因為糖鏈組成可直接影響產品的安全性和有效性��。本方案介紹Agilent AdvanceBio Gly-X 2-AB Express試劑盒在使用PNGase F釋放糖鏈�、通過還原胺化進行標記、在兩小時內(無需一整天或更長時間)凈化游離染料方面的應用�����。所用標記是2-氨基苯甲酰胺 (2-AB)����,因其完善的用途以及與大量歷史糖鏈分析數據的一致性而得到廣泛認可�����。
前言
糖基化是許多生物治療蛋白質的共同特 征�����,可以影響藥代動力學�、藥效學和免疫 原性1����,通常作為關鍵質量屬性2。因此����,必須在整個開發(fā)和生產過程中仔細表征和監(jiān)測生物治療性糖基化。通常在分析之前對糖鏈進行衍生化����,因為它們本身不吸收紫外線或熒光,且難以電 離得到MS檢測��。廣泛使用的熒光標記屈指可數,包括 2-AB 和 2-AA�����,它們通過還原胺化修飾釋放的N-糖鏈3�����。最近推出了具有更高的熒光和MS靈敏度的標記4���。
早期的2-AB標記方案通常較長,需要經歷多個長時間的溫育期�。這不僅耗費了用戶的大量時間,還使用戶無法快速獲得結果并根據這些結果做出決策����。如果不經過長時間溫育,去糖基化通常不完全����,因此常需要過夜消解。通過還原胺化固定2-AB標記是標記前糖鏈干燥的前一步�,標記反應通常需要溫育數小時。此外����,液相色譜分析前用于去除過量2-AB試劑的舊款凈化柱操作繁瑣�,不適用于高通量或自動化工作流程���。
Agilent AdvanceBio Gly-X 2-AB Express 試劑盒的方案包括N-糖鏈樣品前處理的所有高級步驟:變性����、去糖基化�、標記和 樣品凈化,如圖 1 所示���。
實驗部分
材料
HPLC級乙腈購自Sigma-Aldrich����。水經由Milli-Q A10水純化系統(tǒng) (Millipore) 純化��。
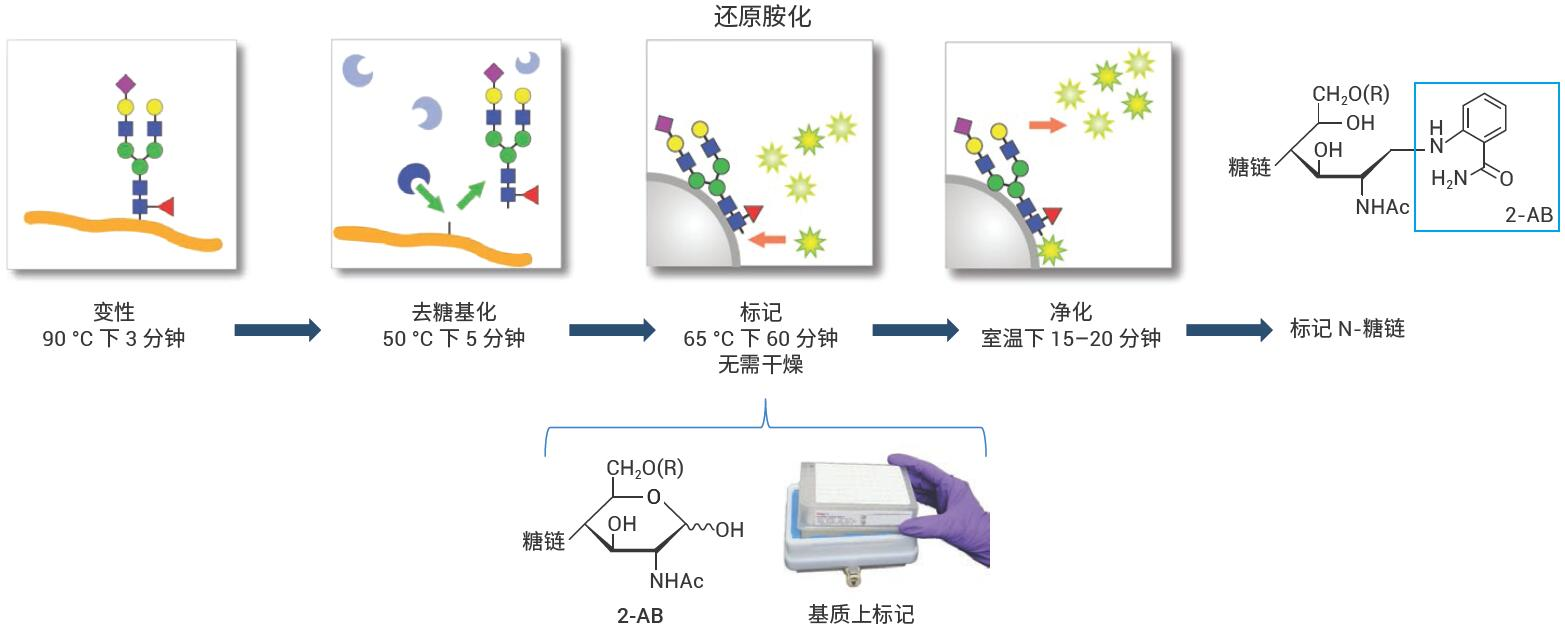
圖 1. 用于釋放和標記 N-糖鏈的AdvanceBio Gly-X 2-AB Express工作流程
N-糖鏈樣品前處理
使用AdvanceBio Gly-X 2-AB Express試劑盒(部件號 GX96-2AB)進行標記N-糖鏈 的樣品前處理���。圖2展示了試劑盒組成����。 AdvanceBio Gly-X N-糖鏈樣品前處理包含一系列酶和化學步驟�,從目標蛋白質的變性開始(圖 3)。加入變性試劑,將樣品在 90 °C 下溫育3分鐘���。蛋白質的有效去折疊有助于PNGase F酶僅在5分鐘內對N-糖鏈實現(xiàn)高效的溶液中酶切4�。PNGase F對N-連接糖鏈具有特異性����,因此僅有N-糖鏈從蛋白質中去除(圖 4),而任何O-連接糖鏈和非酶糖基化仍連接在蛋白質上�。
標記和凈化步驟在HILIC型固相載體 上進行。在上樣到固定相之前�,將釋放N-糖鏈在溶液中轉化為 -OH 形式�����,然后經 2-AB標記試劑標記�,并將固定相在65 °C下溫育1小時(圖 5)。標記完成后����,通過一系列乙腈清洗沖洗掉過量試 劑。然后用水洗脫標記 N-糖鏈(圖 6)�����。 基質上標記省去了在2-AB標記之前干燥釋放糖鏈的步驟。
? ?
圖2.AdvanceBio Gly-X 2-AB Express N-糖鏈樣品前處理試劑盒組成
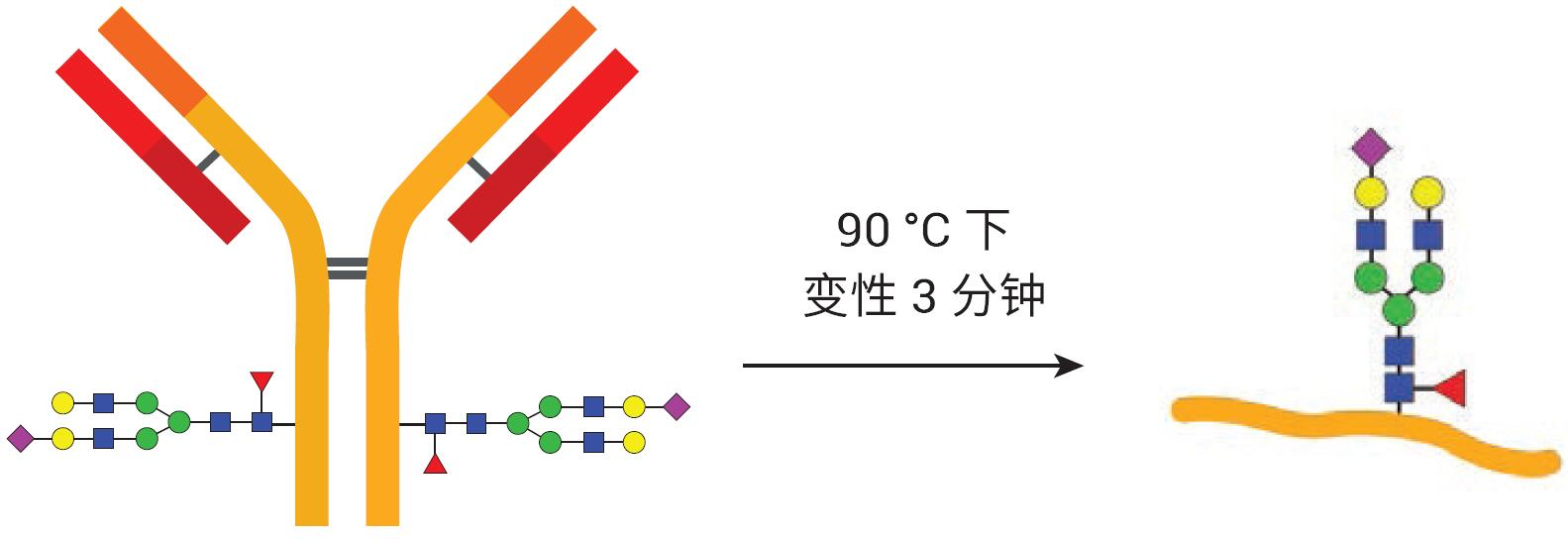
圖3. 首先使樣品蛋白質變性��,以便在后續(xù)步驟中有效去糖基化
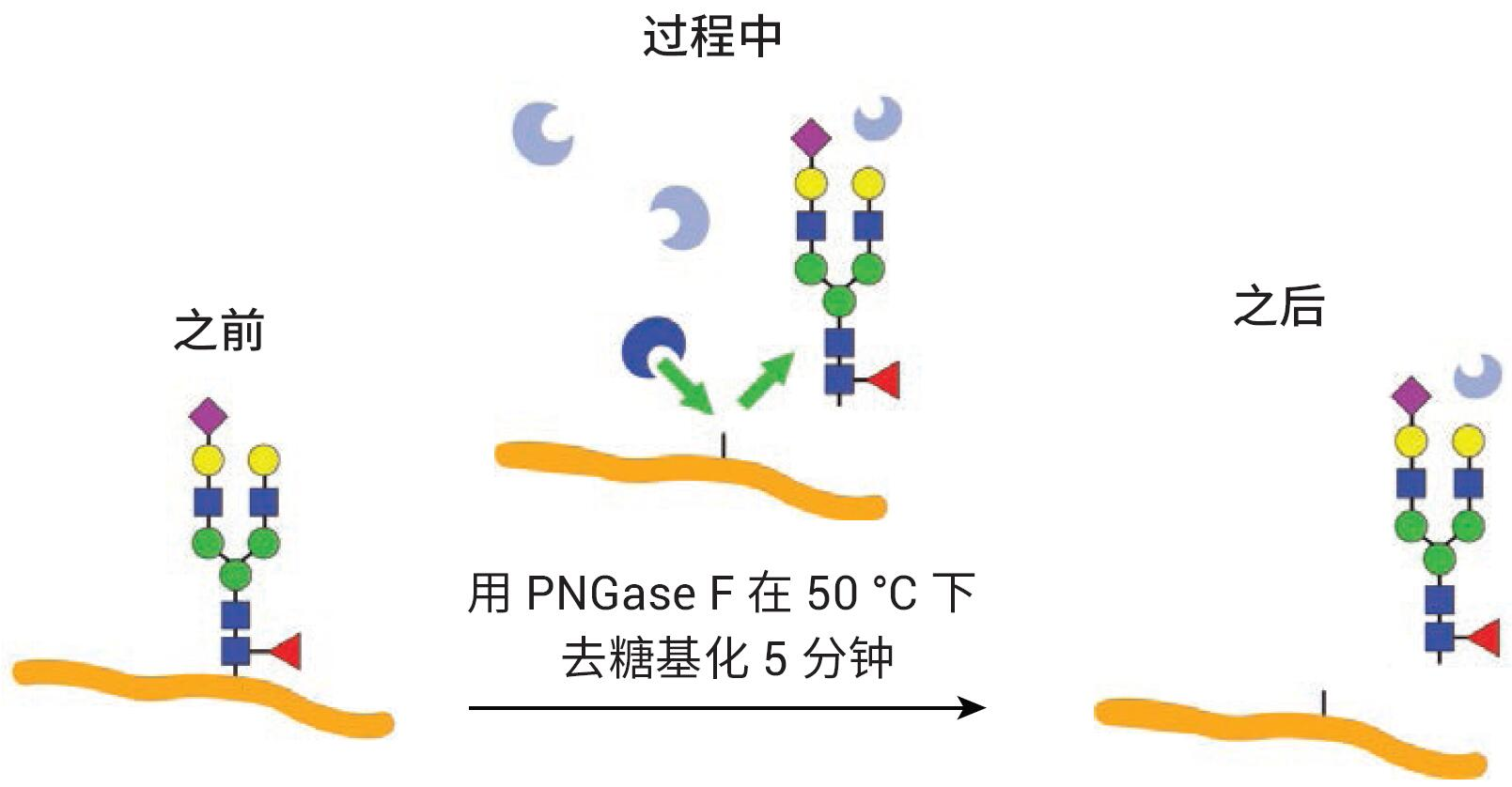
圖4. 采用 PNGase F從蛋白質上快速剪切N-糖鏈

圖5. 將樣品上樣到真空凈化板上的HILIC型固定相擔體上��。然后將2-AB標記試劑加入固定相擔體中�����,溫育1小時����。無需后續(xù)干燥步驟
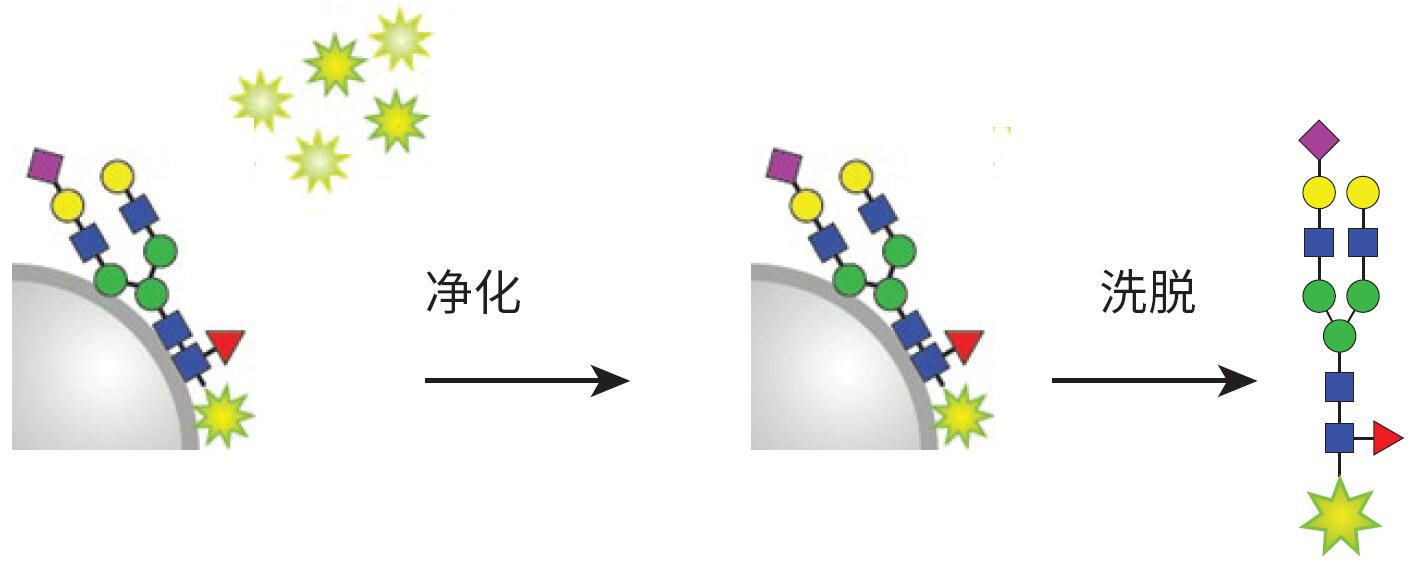
圖6. 沖掉過量標記試劑,從固體固定相中洗脫標記糖鏈
儀器
使用安捷倫液相色譜系統(tǒng)中的Agilent AdvanceBio糖譜分析色譜柱分析樣品�����,系統(tǒng)包括以下模塊:
??Agilent 1290 Infinity II 高速泵(G7120A)
??Agilent Infinity Multisampler(G7167B)
??Agilent 1290 Infinity II 高容量柱溫箱(G7116B)
??Agilent 1260 Infinity 熒光檢測器(G1321B)
軟件
??Agilent MassHunter 采集軟件
??Agilent MassHunter 定性分析軟件
結果與討論
采用 LC/FLD 分析 MabThera 和 Enbrel 2-AB N-糖鏈樣品�。代表性色譜圖如圖 7 所示。MabThera 具有更簡單的糖基化模 式�,Enbrel 則表現(xiàn)出更高的唾液酸化糖鏈水平。樣品前處理的重現(xiàn)性十分重要���,因 此可以比較不同生產批次的樣品���。待測量 的變異性需要是真正來源于樣品的差異�����, 而不是樣品處理或分析造成的人為因素�����。
表 1. 液相色譜方法
| 參數 | 值 |
| 色譜柱 | Agilent AdvanceBio 糖譜分析色譜柱��,2.1×150mm��,1.8μm(部件號 859700-913) |
| 柱溫 | 40 °C |
| 流動相 | A) 50 mmol/L 甲酸銨�,pH4.5��;
B) 乙腈? |
| 流速 | 0.5 mL/min |
| 梯度程序 | 時間 (min)??? %B??????? 流速 (mL/min)? |
0.0? ? ? ? ? ? ? ? 82? ? ? ? ?0.4
|
2.0??????????????? 82???????? 0.4
|
| 2.5??????????????? 77???????? 0.4 |
| 48.0? ? ? ? ? ? ? 62???????? 0.4 |
| 49.0? ? ? ? ? ? ??40???????? 0.4 |
| 51.5? ? ? ? ? ? ? 40???????? 0.4 |
| 52.0? ? ? ? ? ? ??82???????? 0.4 |
| 54.0? ? ? ? ? ? ? 82???????? 0.6 |
| 58.0? ? ? ? ? ? ? 82???????? 0.6 |
| 58.5? ? ? ? ? ? ??82???????? 0.4 |
| 進樣量 | 1μL(相當于0.4μg 蛋白質中的糖鏈) |
| 檢測器 | Agilent 1290 Infinity II FLD?
|
| 激發(fā)波長260nm |
| 發(fā)射波長430nm |
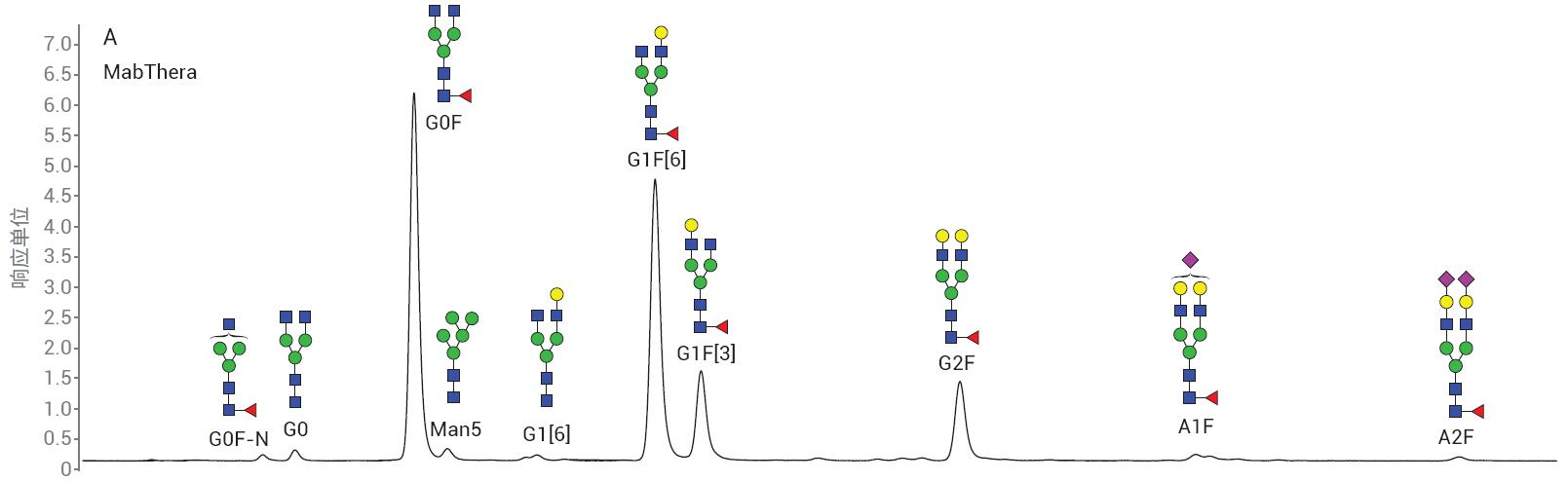
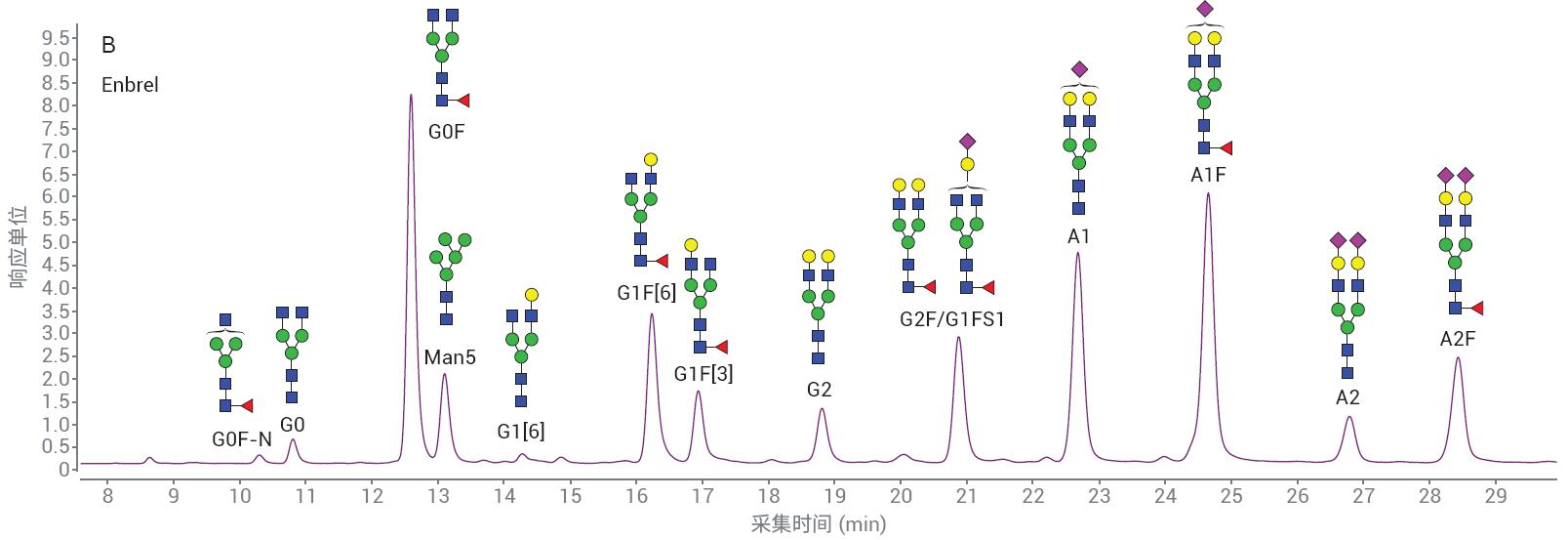
圖7. 顯示從A) MabThera和B) Enbrel分離2-AB標記的N-糖鏈的代表性色譜圖
表2 顯示了MabThera的三份樣品中檢出的主要N-糖鏈種類的相對峰面積百分比�。表中列出了平均百分比峰面積以及標準偏差和相對標準偏差 (%CV)���。除了豐度最低的糖鏈外�,樣品前處理之間的差異都很小�����。檢測限附近的精度較難維持�����,因此預計這些峰的差異會更大。
如果任何研究人員要更改樣品前處理方法����,獲得的數據必須與原方法等同,或在某種程度上優(yōu)于原方法的結果�����。雖然也能用其他標記化學品�����,但繼續(xù)使用2-AB的主要因素是能夠將結果與使用其 他2-AB標記方案獲得的舊數據進行比 較�����。圖8顯示了Enbrel的三份重復樣品中檢出的N-糖鏈的相對峰面積百分比����。 使用AdvanceBio Gly-X 2-AB Express 和 ProZyme GlykoPrep 2-AB(ProZyme提供的前一代2-AB樣品前處理標記物)進行樣品前處理,多次前處理之間的相對豐度相差無幾����。
表2. MabThera 三份樣品中主要N-糖鏈種類的相對峰面積百分比
| 糖鏈? | RT | 相對峰面積百分比 |
| 1 | 2 | 3 | 均值? | 標準偏差 | %CV |
| G0F-N? | 10.32 | 0.56 | 0.57 | 0.57 | 0.57 | 0.01 | 1.02 |
| G0? | 10.81 | 1.09 | 1.01 | 0.98 | 1.03 | 0.06 | 5.54 |
| G0F? | 12.62 | 39.85 | 39.31 | 39.33 | 39.5 | 0.31 | 0.78 |
| Man5 | 13.12 | 0.74 | 0.62 | 0.69 | 0.68 | 0.06 | 8.82 |
| G1[6] | 14.47 | 0.66 | 0.6 | 0.62 | 0.63 | 0.03 | 4.88 |
| G1F[6]? | 16.27 | 34.65 | 34.81 | 34.67 | 34.71 | 0.09 | 0.25 |
| G1F[3]? | 16.96 | 10.65 | 10.47 | 10.6 | 10.57 | 0.09 | 0.88 |
| G2F | 20.89 | 10.15 | 10.78 | 10.83 | 10.59 | 0.38 | 3.58 |
| A1F | 24.45 | 1.13 | 1.26 | 1.17 | 1.19 | 0.07 | 5.61 |
| A2F? | 28.44 | 0.52 | 0.57 | 0.54 | 0.54 | 0.03 | 4.63 |
結論
采用Agilent? AdvanceBio Gly-X 2-AB Express可在兩小時內完成完全的N-糖鏈樣品前處理�����,而舊方法則需要耗費一整 天�����,包括過夜溫育和標記前干燥在內���。各 種糖蛋白生成的數據具有高度重現(xiàn)性,并 與采用舊款2-AB樣品前處理方法獲得的數據一致���。
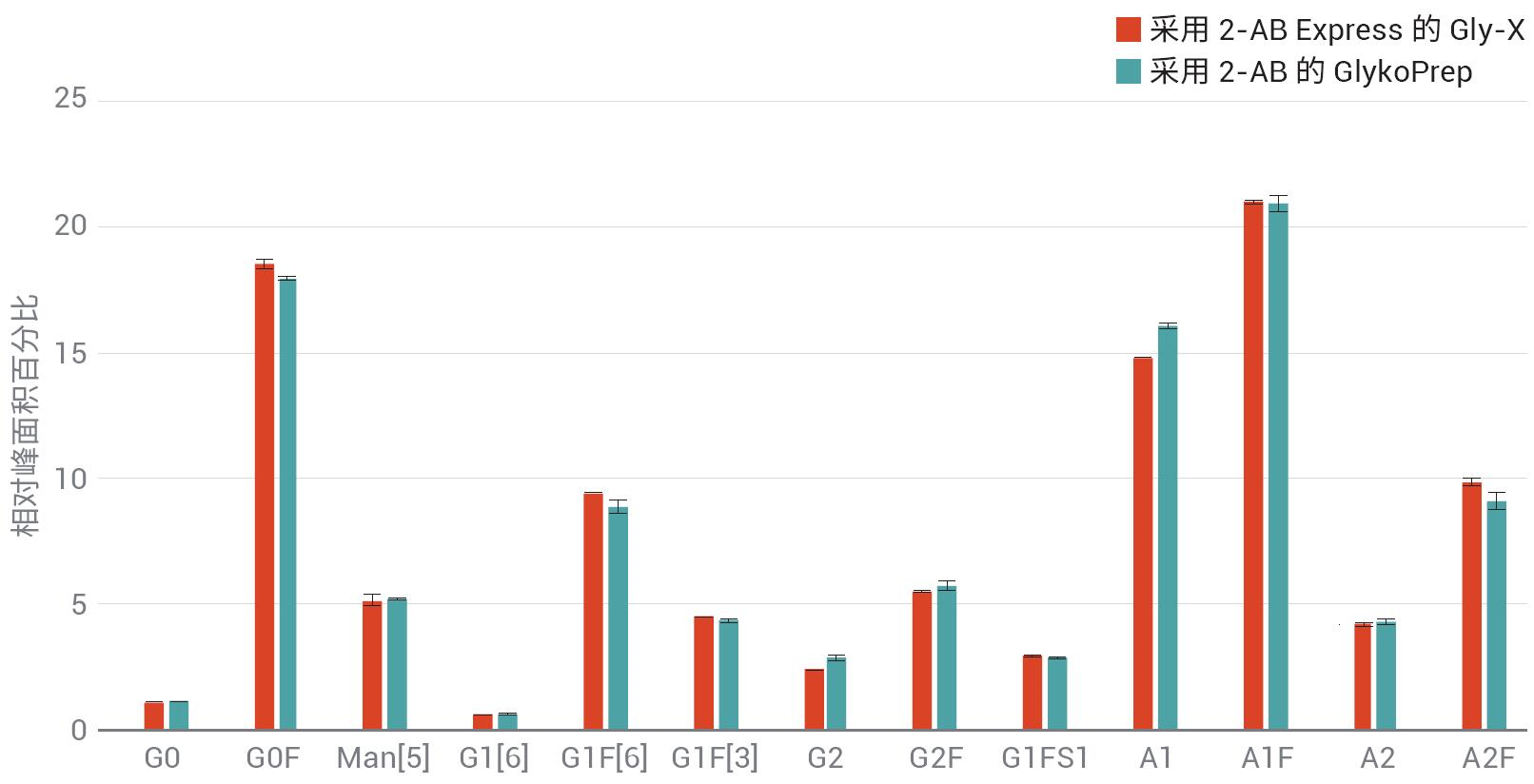
圖8. 采用AdvanceBio Gly-X 2-AB Express試劑盒得到的樣品生成的數據與采用舊方法(如 ProZyme GlykoPrep 2-AB)得到的樣品數據相差無幾��,此處展示的是來自Enbrel的N-糖鏈�����。所有數據均n=3
參考文獻
1.?Liu, L. Antibody Glycosylation and its Impact on the Pharmacokinetics and Pharmacodynamics of Monoclonal Antibodies and Fc-Fusion Proteins. J. Pharm. Sci. 2015, 104(6), 1866–1884
2.?Reusch, D.; Tejada, M. L. Fc Glycans of Therapeutic Antibodies as Critical Quality Attributes. Glycobiology 2015, 25(12), 1325–1334
3.?Ruhaak, L. R.; et al. Glycan Labeling Strategies and Their Use in Identification and Quantification. Anal. Bioanal. Chem. 2010, 397(8), 3457–3481
4.?Kimzey, M.; et al. Development of a?5-Minute Deglycosylation Method for High Throughput N-Glycan Analysis by Mass Spectrometry. ProZyme Technical Note, Bulletin 4001, Rev E
全國服務熱線: 4006-800-892 ? ? ??郵箱: market@neobioscience.com
廣州:18024516375??????????香港: 852-69410778
自主品牌網站: www.neobioscience.net